Das Knochenmarködem (KMÖ) verdankt seine Bezeichnung seinem morphologischen Bild in der Kernspintomographie (MRT). Dank hoch auflösender Bildgebung mittels sogenannter das Fettgewebe unterdrückender Technik, ist das KMÖ sehr sensitiv bereits zum Zeitpunkt seiner Entstehung nur in der MRT nachweisbar. Jede Form des KMÖ hat einen akuten Beginn. Die diagnostische Bildgebung mittels MRT kommt in der Mehrzahl der klinischen Fälle verspätet zum Einsatz, sodass eine Akutphase i. d. R. verpasst wird und ein KMÖ im chronischen Stadium diagnostiziert wird. Das typische Signalverhalten ist hoch empfindlich, jedoch unspezifisch und tritt bei vielen Krankheitsbildern auf (Tab.1). Die hohe Signalintensität in der MRT wird durch vermehrte extrazelluläre Flüssigkeit (Ödem) verursacht.
TAB. 1 ÄTIOLOGIE
I. ischämisches KMÖ 35%
chronic regional pain syndrome-CRPS (M. Sudeck); Osteonekrosen; Osteochondrosis dissecans
II. mechanisches KMÖ 35%
posttraumatisches KMÖ („bone bruise“); Enthesiopathien; Stressfraktur
III. reaktives KMÖ 15%
KMÖ bei Arthrose; postoperatives KMÖ (iatrogen); KMÖ bei Arthritis und Tumor
IV. idiopathisches KMÖ 10% (frühere Bezeichnung: transitorische Osteoporose)
V. schwangerschaftsassoziiertes KMÖ 5% (3. Trimenon; transitorische Osteoporose)
PATHOGENESE
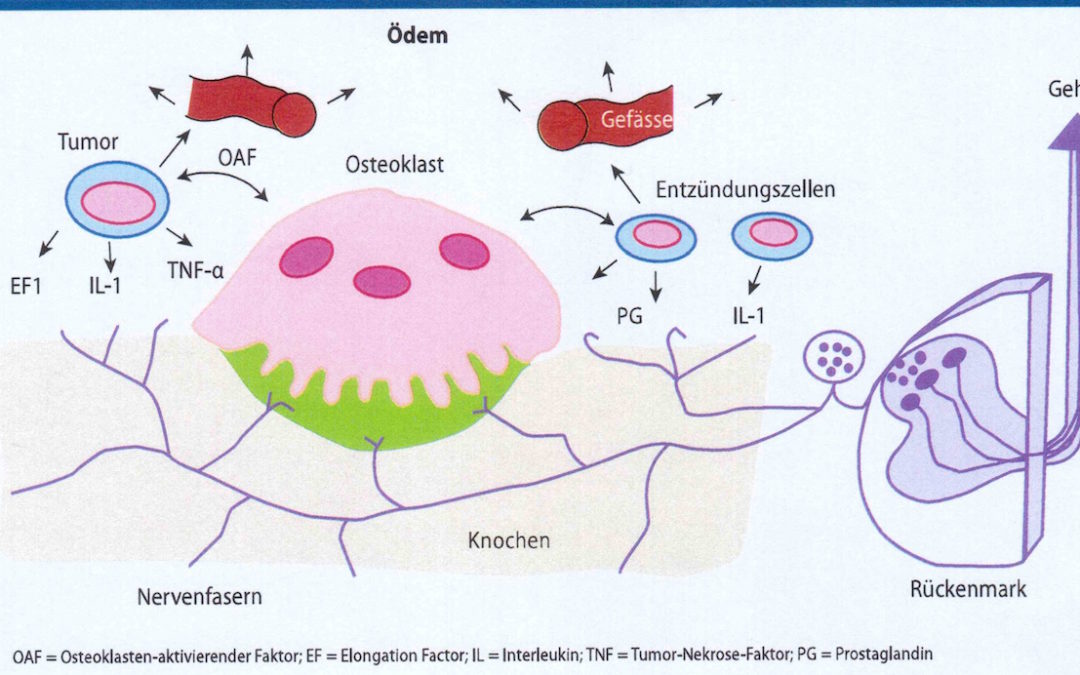
Jedes Ödem geht unabhängig von seiner Ursache und Entstehung aufgrund seines Volumens mit einer Kompression kleinster arteriolärer und venulärer Gefäße und somit eingeschränkter Durchblutung einher. Die hieraus resultierende defizitäre Mikrozirkulation zieht eine fokale Hypoxämie nach sich, die wiederum den Osteoklasten in dessen Aktivität begünstigt. Darüber hinaus stellt sich eine lokoregionäre Azidose ein, die ihrerseits dem Stoffwechsel des Osteoklasten zusätzlich zu Gute kommt und den Osteoblasten hemmt. Somit kommt dem Osteoklasten die entscheidende Rolle bezüglich der Pathogenese zu (Abb.1), unterstützt durch die Freisetzung entzündungsauslösender Zytokine (Prostaglandine, Interleukin1, TNFα).
SYMPTOMATIK
Im Vordergrund der klinischen Symptomatik stehen Schmerzen. Diese sind zum einen Folge erhöhten intraossären Drucks des KMÖ, zum anderen hervorgerufen durch Freilegung und Irritation von Nervenfaserendigungen im Knochenmark bzw. –gewebe. Die Sekretion von Zytokinen trägt nachhaltig zur Verselbständigung eines KMÖ bei. Die Patienten klagen über therapieresistente Schmerzen mit massiver Bewegungseinschränkung in den betroffenen Gelenken bis hin zur Immobilität. Das charakteristische Schmerzbild eines KMÖ ist der mechanische Belastungsschmerz in Verbindung mit einem quälenden, dumpfen Ruhe- bzw. Dauerschmerz.
FORMEN
Tab.1 gibt die aktuell gültige und akzeptierte Einteilung in fünf ätiologisch zu trennende Gruppen wider:
Das iatrogene KMÖ als Sonderform eines reaktiven KMÖ wird zunehmend und auffallend häufig nach arthroskopischer Behandlung von Meniskopathien am Kniegelenk beobachtet.
TAB. 2 THERAPIEOPTIONEN
- mechanische Entlastung durch Ruhigstellung
- medikamentöse Therapie
- ASS, Paracetamol und/oder NSAR
- Bisphosphonate
- operative Verfahren (Entlastungsbohrungen)
- physikalische Therapie/ manuelle Therapie
- physikalische Gefäßtherapie BEMER
THERAPIEOPTIONEN (TAB.2)
Neben konsequenter Entlastung der betroffenen Extremität kommt der medikamentösen Schmerzbehandlung (ASS, Paracetamol, NSAR, im Einzelfall Corticosteroide) eine wichtige Rolle zu. Lebensstiländerung (Gewichtsreduktion, gesunde Ernährung, Einstellen des Rauchens) stellt eine wichtige begleitende Maßnahme dar. In Kenntnis der zentralen Rolle des Osteoklasten im Hinblick auf Pathogenese und Eigendynamik des KMÖ spielen Bisphosphonate (BP) eine wichtige Rolle in der Therapie des KMÖ, da sie den Osteoklasten selektiv hemmen und den Knochenstoffwechsel in ein neues Gleichgewicht bringen. Darüber hinaus hemmen BP die Ausschüttung von Prostaglandin E und Neuromodulatoren an den Nervenendigungen.
Beobachtungsstudien der vergangenen Jahre haben die Wirksamkeit eines intravenös applizierten BP (z.B. 3x Infusion von Ibandronsäure [Bondronat®6mg] alle 4 Wochen) bewiesen. Es sei an dieser Stelle betont, dass der Einsatz von BP für die Behandlung des KMÖ nicht zugelassen ist (off-label use). Eigene Beobachtungen am Bayerischen Osteoporose- Zentrum (Ltg.: Prof. R. Bartl, München), das unserem Radiologischen Institut und der ARP Akademie angeschlossen ist, weisen z.T. erhebliche Nebenwirkungen (NW) der BP-Therapie, einhergehend mit grippeähnlichen Symptomen mit Glieder- und Muskelschmerzen, Temperaturerhöhung und Krankheitsgefühl in > 20% der Fälle auf. Die NW waren umso gravierender je jünger die Patienten waren.
Physikalischer Therapie/manueller Therapie/Faszientherapie kommt angesichts der i d. R. chronisch verlaufenden Krankheitsbilder eine bedeutsame Rolle in der Rehabilitation der die betroffenen Gelenkabschnitte stabilisierenden Muskulatur zu.
Eigene Beobachtungen gemeinsam mit der ARP Akademie an über 100 Patienten haben die Wirksamkeit der Physikalischen Gefäßtherapie BEMER als weitere therapeutische Option zur Behandlung eines KMÖ- Syndrom untermauert. Ziel ist hierbei nicht die Hemmung des Osteoklasten, sondern die Aktivierung der Vasomotion kleinster arteriolärer und venulärer Gefäße zur Verbesserung der defizitären Mikrozirkulation im Knochenmark als wesentlicher zirkulatorischer Mechanismus in der Pathogenese des KMÖ. Es handelt sich um eine nicht randomisierte bzw. nicht placebokontrollierte klinische Beobachtungsstudie, im Rahmen derer betroffene Patienten auf die verschiedenen Therapieoptionen (Tab.2) ausführlich hingewiesen wurden und nach reiflicher Abwägung entschieden, welche Option für sie in Frage kommt.
Entsprechend den Forschungsergebnissen und Empfehlungen des Instituts für Mikrozirkulation – Berlin besteht die Physikalische Gefäßtherapie BEMER aus täglich zweimaliger Anwendung auf dem Ganzkörperapplikator (GK) von jeweils 8 min. im Abstand von ca. 12 h, ergänzt durch beliebig viele lokale Anwendungen mit den dedizierten Applikatoren. Die initiale Intensität auf dem GK betrug i. d. R. in Abhängigkeit von Alter, Dauer und Schmerzintensität 6 – 10, für die lokale Anwendung kam grundsätzlich das Programm P3 mit einer Dauer von 20 min. zur Anwendung. Die Physikalische Gefäßtherapie BEMER erwies sich als komplementäre, erfolgreiche und nebenwirkungsfreie Therapieoption zur Behandlung des KMÖ.
Aufgeschlüsselt nach der Ätiologie lagen bei den 104 Studienteilnehmern folgende KMÖ- Formen vor:
- ischämisches KMÖ (n = 47)
- mechanisches KMÖ (n = 26)
- reaktives KMÖ (n = 21)
idiopathisches KMÖ (n = 8) - schwangerschaftsassoziiertes KMÖ (n = 2)
Nach den betroffenen Skelettabschnitten aufgeschlüsselt, in Reihenfolge der Häufigkeit:
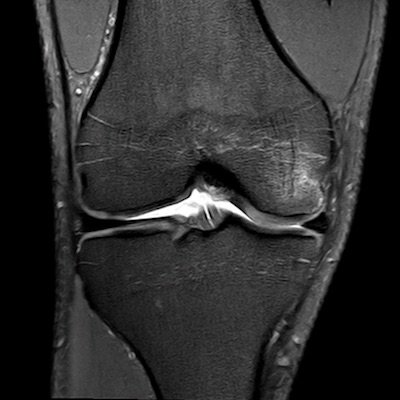
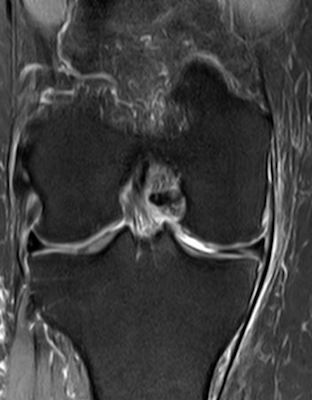
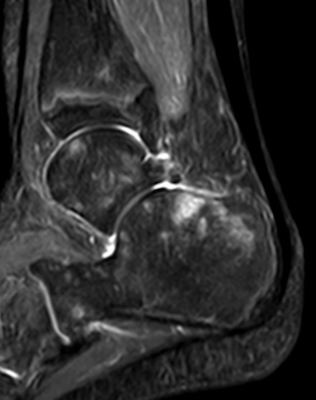
- Kniegelenk (überwiegend medialer Femurkondylus [Abb. 2])
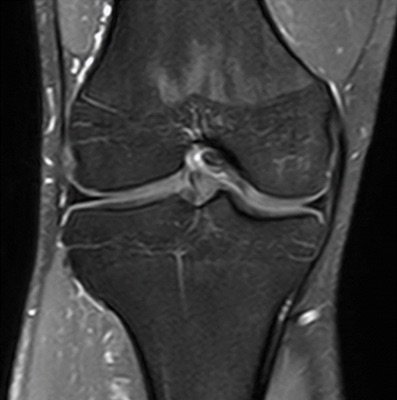
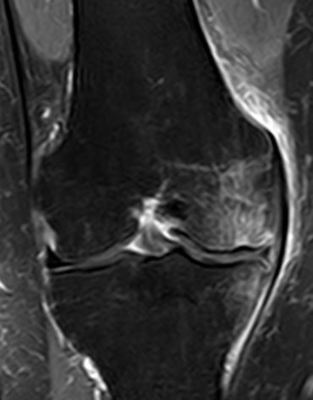
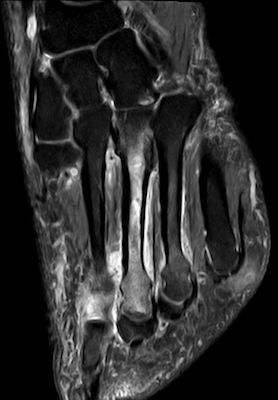
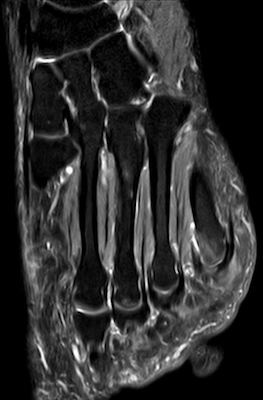
- Fußwurzel und Mittelfuß (insbesondere Talusschulter, Os naviculare, Ossa metatarsalia [Abb. 3+4])
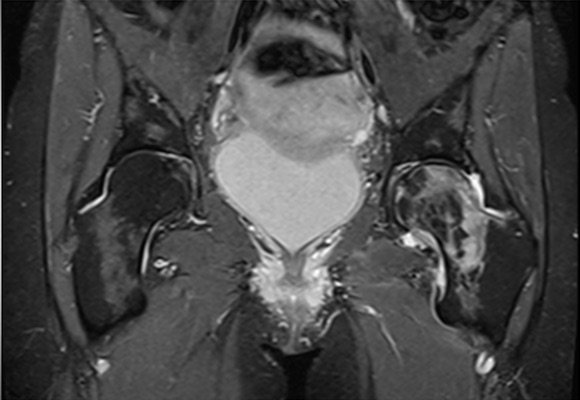
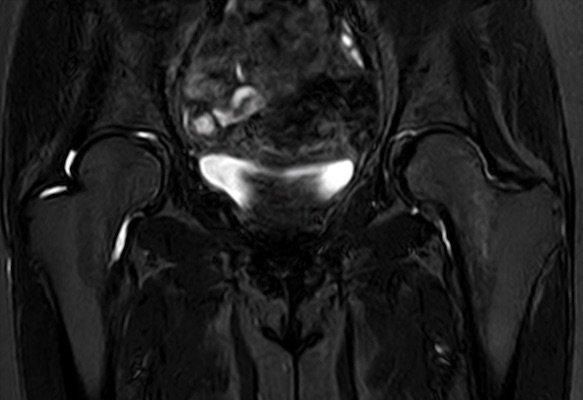
- Hüftkopf ( schwangerschaftsassoziierte Form [Abb. 5 ], Hüftkopfnekrose [Abb. 6])
- Wirbelkörper
Der Beobachtungszeitraum betrug durchschnittlich 3 Monate. Die Patienten bekamen im Rahmen der Studie das Medizinprodukt für die Dauer von bis zu 8-12 Wochen zur Verfügung gestellt. Einige entschieden sich gleich zum Kauf des BEMER- Produkts, andere wiederum wollten es im Rahmen der klinischen Anwendung testen. Eine zweite Bildgebung mittels MRT erfolgte durchschnittlich nach 10 Wochen, in Einzelfällen wünschten Patienten eine zeitnahe Kontrolle der Bildgebung nach vier bzw. sechs Wochen. Linderung von Schmerzen und klinischen Symptomen stellten sich in Abhängigkeit der Krankheitsdauer zwischen 4 Tagen (idiopathische Form) und mehreren Wochen (CRPS) ein.
Eine komplette Remission und Beschwerdefreiheit war in über 80% der Patienten zu beobachten, der klinische Verlauf korrelierte mit der vollständigen Rückbildung des KMÖ in der MRT. 8 Patienten (13%) berichteten von nachhaltiger Besserung der Schmerzsymptomatik, das KMÖ war in der Kontroll-MRT deutlich rückläufig jedoch noch nachweisbar. Bei 6 Patienten (6%) sprach die Physikalische Gefäßtherapie BEMER nicht an, Ursache in allen 6 Fällen war eine fortgeschrittene, mechanisch aktivierte Gonarthrose. Im Vorfeld der klinischen Beobachtung wurde den Patienten dringend ans Herz gelegt, die konsequente mechanische Entlastung für die Dauer der Studie beizubehalten. In 2 Fällen (4%) wurde die körperliche / sportliche Aktivität vorzeitig wieder aufgenommen mit dem Ergebnis, dass ein Rezidiv des KMÖ am betroffenen Gelenk auftrat.
FAZIT
Konsequenter und frühzeitiger Einsatz der Kernspintomographie (MRT) bei Abklärung unklarer Schmerzzustände am Bewegungsapparat der unteren Extremitäten verhindert die Chronifizierung von KMÖ- Syndromen, unabhängig von deren Ätiologie. Verzögerte Diagnosen und Therapien gehen mit schlechterer Prognose einher, insbesondere dann, wenn eine Zerstörung der osteochondralen Grenzzone eingetreten ist. Bisher beschränkte sich die Therapie auf konsequente Entlastung des Gelenks und medikamentöse Analgesie. In früherer Zeit auch auf Entlastungsbohrungen der betroffenen osteochondralen oder enossalen Region und intravenöse Anwendung von BP (off-label use). Physikalische Therapieoptionen spielten bis dato keine wesentliche Rolle.
Als erfolgreiche, einfach durchzuführende und nebenwirkungsfreie Behandlung erwies sich an über 100 Patienten die Physikalische Gefäßtherapie BEMER. Komplette Remission mit Schmerzfreiheit, normaler Beweglichkeit und Belastbarkeit sowie Rückbildung des KMÖ in der MRT, waren in 80% der ätiologisch heterogenen Patientengruppe zu beobachten. Das vorgeschlagene, adjuvant einzusetzende „BEMER- Protokoll“ ist gegenüber invasiver Therapie (Entlastungsbohrung) und BP- Therapie (Nebenwirkungen) eine wertvolle Ergänzung in der Therapie zunehmend häufiger diagnostizierter KMÖ- Syndrome.
Die Physikalische Gefäßtherapie BEMER kann komplementär zur intravenösen Anwendung von BP durchgeführt werden. Klinische Beobachtungen hierzu laufen seit einigen Wochen und werden Gegenstand künftiger Publikationen sein.